Q&A
医療関係者向けQ&A
医療関係者向けQ&A
医療関係者向けQ&A
<埼玉医科大学病院輸血・細胞移植部准教授 岡田 義昭先生(2014年7月監修)>
- Q1.現在販売されている血漿分画製剤でHIV感染はありますか?
- Q2.現在販売されている血漿分画製剤で肝炎ウイルス感染はありますか?
- Q3.現在販売されている血漿分画製剤でプリオン感染(CJDリスク)はありますか?
- Q4.現在販売されている血漿分画製剤でヒトパルボウイルスB19感染はありますか?
- Q5.血漿分画製剤のウイルス等に対する安全性確保対策はどのように実施されていますか?
- Q6.血漿分画製剤の製造工程におけるウイルス不活化・除去はどのように実施されていますか?
- Q7.血漿分画製剤の供血者及び供血された血液・血漿は、どのように選定されていますか?
- Q8.血漿分画製剤の原料となる血液・血漿の採血国、また原料の採取方法の「献血」および「非献血」の定義について教えてください。
- Q9.各種免疫グロブリン製剤とワクチンとの接種間隔について教えてください。
- Q10.血漿分画製剤の残液は、翌日に使用することができますか?
- Q11.血漿分画製剤の投与に際して、患者または家族に記載いただく同意書の見本はありますか?
- Q12.未使用で期限切れとなった血漿分画製剤を廃棄する場合、感染性廃棄物として処理する必要がありますか?
Q1.現在販売されている血漿分画製剤でHIV感染はありますか?
A1.現在国内で販売されている血漿分画製剤の投与と因果関係が確認されたHIV感染の報告はありません。血漿分画製剤は、以下の3段階における安全性確保対策が実施されています。
原料となる血液・血漿を採取する段階で、供血者の問診、ウイルス等の感染症関連のスクリーニング検査を行い、これらの検査に合格した血漿のみを原料として製造に使用します。
製造工程段階では、ウイルスを不活化・除去できるような工程(エタノール処理、加熱処理、SD(有機溶剤/界面活性剤)処理、ウイルス除去膜処理など)が2つ以上組み込まれています。
最終製品段階において、各種ウイルスに対する確認検査が実施され、この検査に合格した製品だけが出荷され、患者さんに使用されています。
また、製造業者はGMPに則って適切に製造管理及び品質管理を行って血漿分画製剤を製造しており、定期的に医薬品医療機器総合機構のGMP調査で確認されています。
Q2.現在販売されている血漿分画製剤で肝炎ウイルス感染はありますか?
A2.現在国内で販売されている血漿分画製剤の投与と因果関係が確認された肝炎ウイルス感染の報告はありません。血漿分画製剤は、以下の3段階における安全性確保対策が実施されています。
原料となる血液・血漿を採取する段階で、供血者の問診、ウイルス等の感染症関連のスクリーニング検査を行い、これらの検査に合格した血漿のみを原料として製造に使用します。
製造工程段階では、ウイルスを不活化・除去できるような工程[エタノール処理、加熱処理、SD(有機溶剤/界面活性剤)処理、ウイルス除去膜処理など]が2つ以上組み込まれています。
最終製品段階において、各種ウイルスに対する確認検査が実施され、この検査に合格した製品だけが出荷され、患者さんに使用されています。
また、製造業者はGMPに則って適切に製造管理及び品質管理を行って血漿分画製剤を製造しており、定期的に医薬品医療機器総合機構のGMP調査で確認されています。
Q3.現在販売されている血漿分画製剤でプリオン感染(CJDリスク)はありますか?
A3.現在国内で販売されている血漿分画製剤の投与と因果関係が確認されたプリオン感染の報告はありません。プリオン感染が懸念されるのは狂牛病(BSE)が原因の変異型クロイツフェルト・ヤコブ病(vCJD)で、血漿分画製剤のプリオン感染対策としては以下の2点があげられます。
海外滞在歴による供血の停止:1980年以降、英国をはじめとする欧州諸国等に一定期間以上滞在した人からの供血をお断りしています。詳細につきましては採血国の基準※をご参照ください。
製造工程でのプリオンの除去:ヒト血液中におけるプリオンたん白の性状や動態は不明な点も多いのですが、分画工程やナノフィルトレーション(ウイルス除去膜)で実験的に添加したプリオンが除去されることが確認されています。
- ※採血国の基準
- 日本:日本赤十字社
- 米国:FDA
- 欧州:EMA(欧州医薬品庁)
Q4.現在販売されている血漿分画製剤でヒトパルボウイルスB19感染はありますか?
A4.現在国内で販売されている血漿分画製剤の投与と因果関係が確認されたヒトパルボウイルスB19感染の報告はありません。血漿分画製剤は、以下の3段階における一般的なウイルス安全性確保対策が実施されています。
原料となる血液・血漿を採取する段階で、供血者の問診、ウイルス等の感染症関連のスクリーニング検査を行い、これらの検査に合格した血漿のみを原料として製造に使用します。
製造工程段階では、ウイルスを不活化・除去できるような工程(エタノール処理、加熱処理、SD(有機溶剤/界面活性剤)処理、ウイルス除去膜処理など)が2つ以上組み込まれています。
最終製品段階において、各種ウイルスに対する確認検査が実施され、この検査に合格した製品だけが出荷され、患者さんに使用されています。
しかしながら、ヒトパルボウイルスB19については、ウイルスの大きさが小さく、脂質エンベロープを有しないため、他のウイルスに比べてウイルス除去膜、SD処理などによる不活化・除去が容易でないため、ウイルスを完全には不活化・除去することが困難であり、製剤中への混入の可能性を否定できませんので、投与後の経過を十分に観察することとされています。
Q5.血漿分画製剤のウイルス等に対する安全性確保対策はどのように実施されていますか?
A5.血漿分画製剤が医療機関に届くまでには、原料血漿段階から製品として出荷されるまで、大きく分けて5つの厳しいウイルス等に対する安全性確保対策が実施されています。以下にその内容を解説いたします。
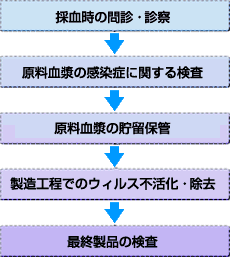
採血時の問診・診察:原料となる血漿を採取する段階で、供血者の健康状態等についての問診・診察が行われます。そして、問題ないと判断された方の血漿のみが、血漿分画製剤の製造に使用される原料の候補となり、次の段階に進みます。
原料血漿の感染症に関する検査:まず、HIV、HBV、HCVについて、血清学的検査が実施されます。これらのウイルスに感染している供血者の血漿はほとんど、この血清学的検査で排除することができます。最近ではウイルスの遺伝子の断片を検出する極めて高感度な検査方法である「核酸増幅法(NAT検査)」が実施されるようになり、HIV、HBV、HCVについて、ウインドウ期を大幅に短縮することが出来るようになりました。
原料血漿の貯留保管:「原料血漿の貯留保管(Inventory Hold)」は、採血後のいろいろな情報を生かして、原料として不適格な血漿を排除するための方策です。先の2つの関門をクリア(合格)した血漿は、一定期間倉庫に貯留保管されます。この間に供血者にウイルス感染等の疑いが出た場合、その供血者から採取された血漿は他の血漿から隔離されます。これら原料段階におけるチェックをクリアした血漿だけが、次の製造工程に進みます。
製造工程でのウイルス不活化・除去:製造工程では、原料血漿から、高度な精製技術を用いて、それぞれ目的とするタンパク質成分を分離・精製して抽出します。万が一ウイルス等が混入した場合でも、そのウイルス等を不活化又は除去できるような工程[エタノール処理、加熱処理、SD(有機溶剤/界面活性剤)処理、ウイルス除去膜処理など]が2つ以上組み込まれています。ウイルスの不活化・除去工程は、ガイドラインに基づきウイルス試験設備で製造工程を忠実に再現した条件でウイルスを添加してその不活化・除去能力を評価し、確認しています。この様に製造工程では、高度な精製が行われるとともに、「ウイルス不活化・除去処理」が施され、最終製品となります。
最終製品の検査:最終製品に対し、各種検査(各種品質試験及びHIV、HBV、HCV、HAV、ヒトパルボウイルスB19のNAT検査等)が実施されます。これらの検査をクリア(合格)した製品だけが出荷され、医療機関に供給されます。
また、製造業者はGMPに則って適切に製造管理及び品質管理を行って血漿分画製剤を製造しており、定期的に医薬品医療機器総合機構のGMP調査で確認されています。
以上、血漿分画製剤のウイルス等に対する安全性確保対策の現状について説明いたしました。これからも、さらに安全性を高めるためのたゆまない努力を続けてまいります。
Q6.血漿分画製剤の製造工程におけるウイルス不活化・除去はどのように実施されていますか?
A6.血漿分画製剤の製造工程における安全性確保対策として、下記のようなウイルス不活化・除去工程が導入されています。
ウイルス不活化・除去効果が確認されている工程
| 工程 | 処理内容 | 効果 |
| 液状加熱処理 | 60℃10時間、液状で加熱処理を施す | HIV、HBV、HCVなど各種ウイルスが不活化される |
| 乾燥加熱処理 | 乾燥状態のまま加熱処理を施す 参考) 実際に導入されている加熱温度・時間などの処理条件は、各社で異なっています |
HIV、HBV、HCVなど各種ウイルスが不活化される |
| SD処理 (有機溶媒/界面活性剤処理) | ウイルスの脂質エンベロープを有機溶媒・界面活性剤で破壊し、脂質エンベロープを持つウイルスの感染性をなくす | HIV、HBV、HCVなどのエンベロープウイルスが不活化される |
| ウイルス除去膜処理 | 様々な孔径のウイルス除去膜を用いて濾過する | HIV、HBV、HCVなど各種ウイルスが除去される |
| エタノール処理 | Cohnのエタノール分画によって、目的とするタンパク質を分離・精製する | HIV、HBV、HCVなど各種ウイルスが不活化・除去される |
| 各種クロマトグラフィ処理 | イオン交換樹脂処理、ゲル濾過処理、イムノアフィニティクロマト処理等により、目的とするタンパク質の吸着並びに夾雑たん白質の吸着・除去を行う | 各種ウイルスが吸着・除去される |
| その他 | PEG(ポリエチレングリコール)処理などでのタンパク質の分離・濃縮 スルホ化処理、ペプシン等の酵素処理や低pHインキュベーション処理 |
各種ウイルスの除去 各種ウイルスの不活化 |
Q7.血漿分画製剤の供血者及び供血された血液・血漿は、どのように選定されていますか?
A7.供血者及び供血された血液・血漿に対する対策は、国内献血血漿と輸入血漿でほぼ同様の対策がとられています。
国内献血時の供血者の選定:日本赤十字社において献血者に身分証明書等の提示をお願いして本人確認が行われます。そして医師による問診が行われ、様々な病原体(マラリア原虫、梅毒、各種ウイルス、異常プリオン等)のリスクを排除しています。
国内献血血液の選定:献血された血液は、梅毒や各種ウイルスに対する抗原・抗体検査、及び核酸増幅検査(NAT)によるウイルス遺伝子の確認が行われ、これら検査に適合した血漿のみが原料として使用されます。なお、原料血漿は一定期間保管(貯留保管)して、献血者からの申し出や遡及調査情報、感染症情報など品質、安全性上問題となる情報がないことを確認しています。
輸入血漿の供血者の選定:PPTA(血漿蛋白製剤協会)におけるIQPP(高品質の原料採取プログラム)に基づき、供血者の健康状態のチェックや身分証明書・社会保障番号の提示による本人確認が行われます。そして医師・看護師等による問診が行われ、様々な病原体(各種ウイルス、異常プリオン等)のリスクを排除しています。
輸入血漿の選定:採漿後に、各種ウイルスに対する抗原・抗体検査、及び核酸増幅検査(NAT)によるウイルス遺伝子の確認が行われ、これら検査に適合した血漿のみが原料として使用されます。そして原料血漿を一定期間貯留保管(Inventry Hold)して、品質、安全性に問題がないことを確認しています。
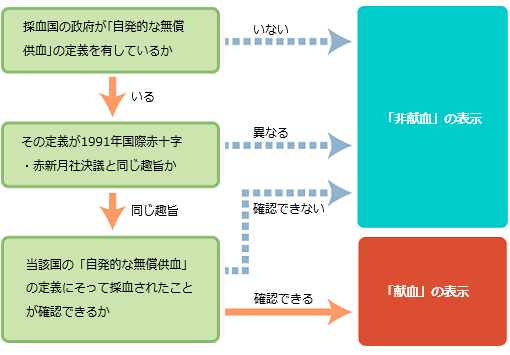
Q8.血漿分画製剤の原料となる血液・血漿の採血国、また原料の採取方法の「献血」および「非献血」の定義について教えてください。
A8.
現在日本国内で販売されている血漿分画製剤には、日本国内で採取された献血血液・血漿を原料とする製剤と、海外で採取された献血血液・血漿(ドイツ、オーストリア)または非献血血液・血漿(アメリカ)を原料とする製剤があります。
「献血」とは「自発的な無償供血」をいいます。日本国内における「献血」がこれに該当しますが、海外においても同様の趣旨に沿って採血されている場合には、「献血」の表示がなされることがあります。それ以外の場合を「非献血」といいます。
現在では製剤ラベルや個装箱に「採血国」及び「献血または非献血」の表示がされています。
〈参考資料〉
「自発的な無償供血」の定義
(平成15年5月15日付厚生労働省医薬局長医薬発0515020号)
「自発的な無償供血」とは、1991年赤十字・赤新月社連盟第8回総会決議第34号により、「供血者が血液、血漿、その他の血液成分を自らの意思で提供し、かつそれに対して、金銭または金銭の代替と見なされる物の支払を受けないことをいう。この支払には休暇も含まれるが、供血及び移動のために合理的に必要とされる休暇は含まれない。少額の物品、軽い飲食物や交通に要した実費の支払は、自発的な無償供血と矛盾しない。」とする。
【献血又は非献血の区別の考え方】
献血又は非献血の区別は製剤の安全性の優劣を示すものではありません。この表示区別は、下記の手順に従って決められています。
Q9.各種免疫グロブリン製剤とワクチンとの接種間隔について教えてください。
A9.免疫グロブリン製剤(特殊免疫グロブリン製剤を含む)とワクチンの接種間隔については、製剤の種類・投与量、ワクチンの種類によって異なります。非経口生ワクチンは免疫グロブリン製剤による中和反応の影響が大きいと考えられており、免疫グロブリン製剤投与から3か月以上間隔をあけての接種となります。また、免疫グロブリン製剤を大量(200mg/kg以上)投与した場合※には非経口生ワクチンの接種は6か月以上(麻疹感染の危険性が低い場合の麻疹ワクチンは11か月以上)あけての接種となります。その他の経口生ワクチン、不活化ワクチン、トキソイドに関しては、生ワクチンほどの影響はないと考えられ、接種間隔に特段の規定は設けられていません。特殊免疫グロブリン製剤のうち抗破傷風人免疫グロブリンと抗HBs人免疫グロブリンは、不活化ワクチンと同時に使用されることも多くありますが、ワクチンの効果に影響はほとんどないとされています。
なお、非経口生ワクチン接種後14日以内に免疫グロブリン製剤を投与した場合は、投与後3か月以上経過した後に生ワクチンを接種することが望ましいとされています。
各種免疫グロブリン製剤とワクチンとの接種間隔
| 免疫グロブリン製剤(特殊免疫グロブリン製剤を含む) | 免疫グロブリン製剤の大量療法(200mg/kg以上) | |
| 非経口生ワクチン (麻疹、おたふくかぜ、風疹、これら混合、水痘等) |
3か月以上 | 6か月以上(麻疹感染の危険性が低い場合の麻疹ワクチンは11か月以上) |
| 経口生ワクチン (ポリオ、ロタ等) |
特に規定なし | 特に規定なし |
| 不活化ワクチン (インフルエンザ、Hib、三種混合、HAV、HBV、ポリオ等) |
特に規定なし | 特に規定なし |
| トキソイド (破傷風、ジフテリア等) |
特に規定なし | 特に規定なし |
※大量(200mg/kg)投与した場合とは、以下の適応症の用量が該当します。
特発性血小板減少性紫斑病(ITP)、川崎病、ギラン・バレー症候群、好酸球性多発血管炎性肉芽腫症、多巣性運動ニューロパチー(MMN)を含む慢性炎症性脱髄性多発根神経炎(CIDP)、全身型重症筋無力症、天疱瘡、水疱性類天疱瘡、スティーブンス・ジョンソン症候群及び中毒性表皮壊死症、腎移植術前脱感作、視神経炎の急性期
新型コロナワクチンとの接種間隔については、明確なエビデンスは得られておりません。
(出典:各社添付文書)
Q10.血漿分画製剤の残液は、翌日に使用することができますか?
A10.使用後の残液は細菌等による汚染のおそれがありますので、使用しないでください。
血漿分画製剤は細菌等などが繁殖しやすいタンパク質製剤ですので、万一混入するかもしれない細菌等の増殖のおそれがあります。
Q11.血漿分画製剤の投与に際して、患者または家族に記載いただく同意書の見本はありますか?
A11.同意書はそれぞれの医療機関で院内の手順に基づき作成されていると考えられますので、見本は作成していません。
<参考>
Q12.未使用で期限切れとなった血漿分画製剤を廃棄する場合、感染性廃棄物として処理する必要がありますか?
A12.未使用の血漿分画製剤は、非感染性廃棄物として取り扱ってください。詳細は下記の判断フローを参考にしてください。
【感染性廃棄物の判断フロー】

(注) 次の廃棄物も感染性廃棄物と同等の取扱いとする。
- ・外見上血液と見分けがつかない輸血用血液製剤等
- ・血液等が付着していない鋭利なもの(破損したガラスくず等を含む。)
(注1) ホルマリン固定臓器等を含む。
(注2) 病原体に関連した試験、検査等に使用した培地、実験動物の死体、試験管、シャーレ等
(注3) 医療器材としての注射針、メス、破損したアンプル・バイアル等
(注4) 感染症法により入院措置が講ぜられる一類、二類感染症、新型インフルエンザ等感染症、指定感染症及び新感染症の病床
(注5) 医療器材(注射針、メス、ガラスくず等)、ディスポーザブルの医療器材(ピンセット、注射器、カテーテル類、透析等回路、輸液点滴セット、手袋、血液バック、リネン類等)、衛生材料(ガーゼ、脱脂綿、マスク等)、紙おむつ、標本(検体標本)等
なお、インフルエンザ(鳥インフルエンザ及び新型インフルエンザ等感染症を除く。)伝染性紅班、レジオネラ症等の患者の紙おむつ(参考1参照)は、血液等が付着していなければ感染性廃棄物ではない。
(注6) 感染性・非感染性のいずれかであるかは、通常はこのフローで判断が可能であるが、このフローで判断できないものについては、医師等(医師、歯科医師及び獣医師)により、感染のおそれがあると判断される場合は感染性廃棄物とする。
【環境省 廃棄物処理法に基づく感染性廃棄物処理マニュアル 令和4年6月改訂版より引用・改変】
